Применение алюминия и его соединений — урок. Химия, 8–9 класс.
Алюминий применяется чаще всего как простое вещество.
Этот лёгкий и устойчивый к коррозии металл широко используется для получения сплавов, которые находят применение в авиационной и космической технике, речных судах и катерах, автомобилях, а также в промышленности для изготовления посуды, бытовой техники и др.

Алюминий обладает высокой электропроводностью. Поэтому его используют при изготовлении электрических проводов и кабелей.
Из-за высокой теплопроводности алюминий и его сплавы применяют при производстве радиаторов для обогрева и отвода теплоты.
Мелкодисперсный алюминиевый порошок (алюминиевая пудра) используется в качестве пигмента в красках.
Природный минерал корунд, представляющий собой чистый кристаллический оксид алюминия, из-за высокой твёрдости используется в качестве абразивного материала.
Синтетический оксид алюминия широко применяется в производстве керамики, устойчивой при очень высоких температурах.
Природные монокристаллы оксида алюминия (минералы рубин, сапфир) являются драгоценными камнями и используются в производстве ювелирных украшений.
Очень большое значение имеет каолинит, значительные количества которого расходуются при производстве цемента, который используется в строительстве.
Источники:
Иллюстрации: http://cf.ppt-online.org/files/slide/g/g4IW8Z9OvHNy7wPYmf/slide-8.jpg
www.yaklass.ru
Алюминий и его соединения. Свойства и применение алюминия
 Урок химии 13 — Алюминий и его соединения. Свойства и применение алюминия.
Урок химии 13 — Алюминий и его соединения. Свойства и применение алюминия.
В периодической таблице алюминий находится в третьем периоде, в главной подгруппе третьей группы. Заряд ядра +13. Электронное строение атома 1s22s22p63s23p1.
Наиболее характерная степень окисления атома алюминия +3. Отрицательная степень окисления проявляется редко. Во внешнем электронном слое атома существуют свободные d-подуровни. Благодаря этому его координационное число в соединениях может равняться не только 4 ([AlCl4]—, [AlH4]—, алюмосиликаты), но и 6 (Al2O3,[Al(OH2)6]3+).
Алюминий — типичный амфотерный элемент. Для него характерны не только анионные, но и катионные комплексы. Так, в кислой среде существует катионный аквакомплекс [Al(OH
В виде простого вещества алюминий — серебристо-белый, довольно твердый металл с плотностью 2,7 г/см3 (т. пл. 660 оС, т. кип. ~2500 оС). Кристаллизуется в гранецентрированной кубической решетке. Характеризуется высокой тягучестью, теплопроводностью и электропроводностью (составляющей 0,6 электропроводности меди). С этим связано его использование в производстве электрических проводов. При одинаковой электрической проводимости алюминиевый провод весит вдвое меньше медного.
На воздухе алюминий покрывается тончайшей (0,00001 мм), но очень плотной пленкой оксида, предохраняющей металл от дальнейшего окисления и придающей ему матовый вид. При обработке поверхности алюминия сильными окислителями (конц. HNO
Алюминий легко вытягивается в проволоку и прокатывается в тонкие листы. Алюминиевая фольга (толщиной0,005 мм) применяется в пищевой и фармацевтической промышленности для упаковки продуктов и препаратов.
Основную массу алюминия используют для получения различных сплавов, наряду с хорошими механическими качествами характеризующихся своей легкостью. Важнейшие из них — дюралюминий (94% Al, 4% Cu, по 0,5% Mg, Mn, Fe и Si), силумин (85 — 90% Al, 10 — 14% Si, 0,1% Na) и др. Алюминиевые сплавы применяются в ракетной технике, в авиа-, авто-, судо- и приборостроении, в производстве посуды и во многих других отраслях промышленности. По объему применения сплавы алюминия занимают второе место после стали и чугуна.
Алюминий, кроме того, применяется как легирующая добавка ко многим сплавам для придания им жаростойкости.
Химические свойства. Реагирует с неметаллами:
4Al + 3O2 → 2Al2O3 ; 2Al + 3Br
c оксидами металлов:
2Al + Fe2O3 → Al2O3 + 2Fe (алюмотермия)
c водой (если удалить оксидную пленку):
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
c кислотами ( HCl и Н2SO4 пассивируется конц. HNO3 ):
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
c щелочами:
2Al + 2NaOH + 6H2О → 2Na [Al(OH)4] + 3H2↑
Оксид алюминия представляет собой белую, очень тугоплавкую (т. пл. 2050 оС) и нерастворимую в воде массу. Природный Al2O3 (минерал корунд), а также полученный искусственно и затем сильно прокаленный отличается большой твердостью и нерастворимостью в кислотах. В растворимое состояние Al2O3 (т. н. глинозем) можно перевести сплавлением со щелочами.
Ввиду нерастворимости Al2O3 в воде, отвечающий этому оксиду гидроксид Al(OH)3 может быть получен лишь косвенным путем из солей. Получение гидроксида можно представить в виде следующей схемы. При действии щелочей ионами OH
[Al(OH2)6]3+ + OH— = [Al(OH)(OH2)5]2+ + H2O
[Al(OH)(OH2)5]2+ + OH— = [Al(OH)2(OH2)4]+ + H2O
[Al(OH)2(OH2)4]+ + OH— = [Al(OH)3(OH2)3]0 + H2O
Al(OH)3 представляет собой объемистый студенистый осадок белого цвета, практически нерастворимый в воде, но легко растворяющийся в кислотах и сильных щелочах. Он имеет, следовательно, амфотерный характер. Однако и основные и особенно кислотные его свойства выражены довольно слабо. В избытке NH
При взаимодействии с сильными щелочами образуются соответствующие алюминаты:
NaOH + Al(OH)3 = Na[Al(OH)4]
Алюминаты наиболее активных одновалентных металлов в воде хорошо растворимы, но ввиду сильного гидролиза растворы их устойчивы лишь при наличии достаточного избытка щелочи. Алюминаты, производящиеся от более слабых оснований, гидролизованы в растворе практически нацело и поэтому могут быть получены только сухим путем (сплавлением Al
С кислотами Al(OH)3 образует соли. Производные большинства сильных кислот хорошо растворимы в воде, но довольно значительно гидролизованы, и поэтому растворы их показывают кислую реакцию. Еще сильнее гидролизованы растворимые соли алюминия из слабых кислот. Вследствие гидролиза сульфид, карбонат, цианид и некоторые другие соли алюминия из водных растворов получить не удается.
Галогениды алюминия в обычных условиях — бесцветные кристаллические вещества. В ряду галогенидов алюминия AlF
Al2O3 + 6HF = 2AlF3 + 3H2O
Соединения алюминия с хлором, бромом и иодом легкоплавки, весьма реакционноспособны и хорошо растворимы не только в воде, но и во многих органических растворителях. Взаимодействие галогенидов алюминия с водой сопровождается значительным выделением теплоты. В водном растворе все они сильно гидролизованы, но в отличие от типичных кислотных галогенидов неметаллов их гидролиз неполный и обратимый. Будучи заметно летучими уже при обычных условиях, AlCl
Сульфат алюминия Al2(SO4)3.18H2O получается при действии горячей серной кислоты на оксид алюминия или на каолин. Применяется для очистки воды, а также при приготовлении некоторых сортов бумаги.
Алюмокалиевые квасцы KAl(SO4)2.12H2O применяются в больших количествах для дубления кож, а также в красильном деле в качестве протравы для хлопчатобумажных тканей. В последнем случае действие квасцов основано на том, что образующиеся вследствие их гидролиза гидроксид алюминия отлагается в волокнах ткани в мелкодисперсном состоянии и, адсордбируя краситель, прочно удерживает его на волокне.
Из остальных производных алюминия следует упомянуть его ацетат (иначе — уксуснокислую соль) Al(CH3COO)3, используемый при крашении тканей (в качестве протравы) и в медицине (примочки и компрессы). Нитрат алюминия легко растворим в воде. Фосфат алюминия нерастворим в воде и уксусной кислоте, но растворим в сильных кислотах и щелочах.
Это был урок химии 13 — Алюминий и его соединения. Свойства и применение алюминия.
Friend me:
к нашему сайту.
Химические соединения алюминия
Ниже представлен краткий обзор важнейших химических соединений алюминия, которые находятся в природных условиях, а также их промышленного применения.
Что такое химическое соединение?
Химическое соединение алюминия – это вещество, которое образовано из двух или более химических элементов, одним из которых является алюминий. Эти элементы связаны между собой химически, то есть путем ковалентных, ионных или металлических связей. Химическое соединение имеет фиксированный химический состав и постоянную химическую формулу.
Алюминиевые сплавы обычно не являются химическими соединениями. Они являются гомогенными или гетерогенными смесями входящих в них химических элементов или соединений. Поэтому они не имеют фиксированного химического состава и не имеют химической формулы.
Алюминий в природе
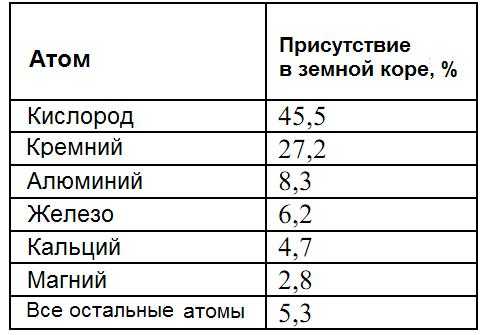
Алюминий является самым распространенным (более 8 % по массе) природным металлическим элементом, а также третьим природным элементом среди всех химических элементов (после кислорода и кремния). Однако из-за высокой химической активности алюминия он почти всегда находится в соединениях с другими элементами и очень редко встречается в природе в виде чистого металла.
Таблица – Доля химических элементов в земной коре
Металлический алюминий
Чистый алюминий – это серебристо-белый, ковкий, пластичный металл с атомным номером 13 и относительной атомной массой 26,98. За небольшими исключениями он находится в химических соединениях в виде Al+3.
Этот металл обладает амфотерными свойствами. Он реагирует с минеральными кислотами и сильными щелочами. Хотя алюминий является одним из самых химически активных промышленных металлов, он имеет очень высокое сопротивление коррозии. При контакте свежей алюминиевой поверхности с кислородом, водой или другими окислителями на ней мгновенно вырастает плотная оксидная пленка (Al2O3), которая обеспечивает металлу высокую стойкость к коррозии. Эта оксидная пленка растворяется в щелочных растворах с выделением водорода и образованием растворимых щелочноземельных алюминатов [1].
Эта оксидная пленка является стойкой к некоторым кислотам (например, азотной кислоте) и предотвращает дальнейшее химическое воздействие на металл. Однако она растворяется в некоторых кислотах (например, в соляной кислоте или горячей серной кислоте), а также в щелочных растворах, что делает возможным дальнейшие химические реакции на поверхности алюминия.
При повышенных температурах алюминий реагирует:
- с водой (выше 180 ºС) с образованием гидроксида Al(OH)3 и водорода H2;
- со многими оксидами металлов с образованием оксида Al2O3 и металла, восстановленного из его оксида.
Последняя реакция применяется при производстве некоторых металлов (алюмотермия), например, марганца и некоторых сплавов, например, ферротитана.
Природные соединения
Минералы
Природные минералы являются химическими соединениями. Алюминий присутствует во многих минералах – более 270 видов – в комбинациях с кислородом, кремнием, щелочными и щелочноземельными металлами и фтором, а также в виде гидроксидов, сульфатов и фосфатов. Например, полевые шпаты – наиболее распространенные минералы земной коры (около 50 %) – являются алюминосиликатами [1].
Металлический алюминий в природе
Природный металлический алюминий иногда находят как минорную фазу в условиях недостатка кислорода, например, внутри некоторых вулканов. Он также встречается в таких минералах, как берилл, криолит, гранат, шпинель и бирюза [1].
Драгоценные камни
Примеси в кристаллах оксида Al2O3, такие как хром или кобальт дают драгоценные камни рубин и сапфир, соответственно. Чистый оксид Al2O3 известен как корунд – один из самых твердых материалов.

Рубин
Бокситы
Хотя алюминий и является очень распространенным природным элементом, большинство алюминиевых минералов не могут быть экономически выгодными источниками этого металла. Почти весь металлический первичный алюминий производится из руды, которая называется бокситом (или бокситами) с обобщенной химической формулой (AlOx(OH)3-2x) [1].
Бокситы происходят в природе как продукты выветривания коренных пород с низким содержанием железа и кремния в тропических климатических условиях. Природные бокситы содержат различные гидратированные формы оксида алюминия, которые имеют различные кристаллические системы, а также различаются по степени гидратации (количеству молекул воды на одну молекулу Al2O3).
Производство глинозема
Около 90 % алюминиевых руд – бокситов – идет на производство первичного алюминия, остальные 10 % – на другие промышленные применения.
Промышленное производство первичного алюминия имеет две основных стадии:
- производство из исходной бокситной руды чистого оксида алюминия – глинозема;
- электрохимическое восстановление этого оксида до металлического алюминия в ванне расплавленного криолита.
Бокситы
Боксит не является минералом и химическим соединением. Это наименование – боксит (или, чаще, бокситы) – применяется для обозначения различных типов алюминиевых руд, которые содержат соединения алюминия, в основном – различные виды гидроксидов.
Промышленные бокситы содержит три основных типа гидроксидных минералов:
- гибсит: Al2O3·3H2O
- богемит – Al2O3·H2O
- диаспор – Al2O3·H2O.
Эти типы гидроксидов значительно различаются по таким физическим свойствам, как:
- содержание воды,
- кристаллическая система
- твердость,
- плотность,
- температура дегидратации
- растворимость в технологических растворах.
Обычно природные залежи бокситов состоят из одного из этих типов гидроксидов, хотя в некоторых случаях одна и та же алюминиевая руда может содержать смешанные гидроксиды.
Бокситы различаются по цвету от кремового до темно коричневого при высоком содержании железа.

Типичный боксит
В состав типичного боксита для промышленного производства алюминия входят следующие соединения:
- оксид алюминия – Al2O3: 40-60 %
- оксид кремния – SiO2: 1-6 %
- оксид железа – Fe2O3: 2-25 %
- оксид титана – TiO2: 1-5 %
- оксиды кальция и магния – CaO + MgO: 0,2-0,6 %
- оксиды других элементов: от 0,01 до 0,4 % (каждого).
Глинозем
Почти весь глинозем получают из бокситов, которые содержат около 50 % оксида Al2O3 в виде гидроксидов. Эту алюминиевую руду обрабатывают в растворе каустической соды под давлением, чтобы растворить оксид алюминия в виде алюмината, и отделить его от красного осадка, содержащего оксиды железа и другие основные примеси. Затем из этого раствора алюмината осаждают кристаллы гидроксида алюминия.
При температуре ниже 700 ºС в технологической массе содержатся следующие различные типы соединений алюминия – его гидроксидов:
- гиббсит
- байерит
- нордстрандид
- диаспор
- богемит.
Завершающей технологической операцией производства глинозема является обжиг полученной на предыдущих этапах смеси гидроксидов. Обжиг (кальцинация) производится при температуре 1200 ºС с получением на выходе чистого глинозема с содержанием оксида Al2O3 более 99 %.
Глинозем
Для промышленного производства 1 тонны алюминия требуется около 2 тонн глинозема.
Соединениями алюминия, которые являются наиболее важными для неметаллургических отраслей промышленности – являются его:
- оксид;
- сульфат и
- силикат.
Оксид алюминия
Кислородное соединение алюминия
Оксид алюминия – это одно из его кислородных соединений. Чистый оксид – это белый порошок в виде частиц различной формы и размеров. Из-за своих амфотерных свойств этот оксид растворяется в минеральных кислотах и сильных щелочах. Он может иметь различные модификации. Наиболее стабильным является его альфа-модификация «корунд» (альфа-Al2O3).
Типы оксидов
При дегидратации гидроксидов образуется серия типов оксида Al2O3, которые еще содержат небольшую долю гидроксильных групп и сохраняют некоторую химическую активность. Все оксиды, которые получены при пониженных температурах называют переходными модификациями. При температуре 1400 ºС все переходные модификации превращаются в альфа-модификацию [1].
Анодный оксид
Анодный оксид получают путем электрохимического оксидирования алюминия. Это соединение представляет собой наноструктурированный материал с уникальной структурой. Анодный алюминиевый оксид состоит из цилиндрических пор, которые обеспечивают ему широкое применение в технике. Он является термически и механически устойчивым, оптически прозрачным и обладает высокими электроизоляционными свойствами. Размер пор и толщина анодного оксидного слоя легко регулируется параметрами технологии, что дает возможность его применения не только как защитного декоративного покрытия для алюминиевых изделий, но и как основу для нанотехнологий.
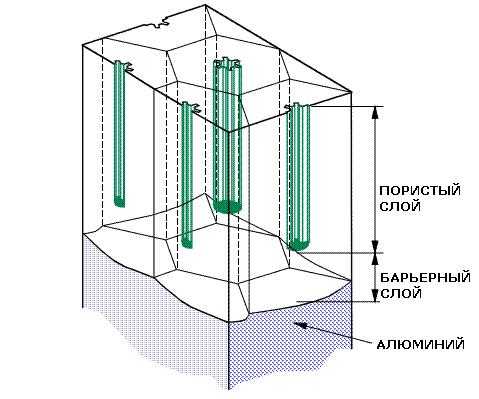
Структура анодного оксидного покрытия
Гидроксиды
Известны различные формы гидроксидов алюминия. Наиболее изученными формами являются тригидроксид Al(OH)3 и оксид-гидроксид AlO(OH). Кроме этих кристаллических форм известны еще несколько других типов [1].
Гидроксид Al(OH)3 применяется в больших объемах для очистки сточных вод, а также для производства других соединений алюминия, в том числе его солей.
Сульфат алюминия
Структура и состав
Сульфат алюминия может существовать с различными пропорциями воды. Обычной формой этого соединения является Al2(SO4)3·18H2O. Он почти нерастворим в обезвоженном спирте, но хорошо растворяется в воде. При температуре выше 770 ºС разлагается до оксида алюминия.
Применение
Находит применение в следующих отраслях промышленности и областях жизни [1, 2]:
- системы очистки воды и обработки сточных вод;
- производство бумаги;
- противопожарная защитная одежда;
- очистка масел и жиров;
- гидроизоляция бетона;
- производство антиперспирантов;
- выделка кож;
- производство красок;
- в сельскохозяйственных пестицидах;
- производство химикатов;
- средство для повышения кислотности почв;
- производство косметики и мыла;
- в медицинских препаратах.
Квасцы
Сульфат алюминия входит в комбинацию с сульфатами одновалентных металлов с образованием двойных солей, которые называются квасцами. Наиболее важным из этих солей является алюминиевый сульфат калия. Это химическое соединение также известно как калиевые квасцы. Эти квасцы имеют широкое применение с глубокой древности в производстве кожи, лекарств, тканей и красок.
Глины
Глины состоят в основном из алюмосиликатов.
Хлорид
При взаимодействии газообразного хлора с расплавленным алюминием образуется хлорид алюминия. Это соединение наиболее часто применяется как катализатор в реакциях синтеза различных органических соединений. Гидратированный хлорид AlCl3∙H2O, применяется как антипреспирант или дезодорант. Это соединение является одной из нескольких алюминиевых солей, которые применяются к косметической промышленности.
Гексагидратная форма хлорида алюминия применяется:
- для защитной обработки древесины,
- как дезинфицирующее средство в животноводстве и при производстве мяса;
- очистке сырой нефти
- производство бумаги
Гидрид алюминия
С водородом алюминий образует гидрид AlH3, который широко применяется в органической химии, в том числе, в виде литиевого гидрида алюминия (LiAlH4). Это соединение получают при взаимодействии хлорида алюминия с хлоридом лития.
Интерметаллические соединения
Интерметаллид (интерметаллическое соединение) — это химическое соединение двух или более металлов. Интерметаллиды, как это и должно быть у химических соединений, имеют фиксированное соотношение между своими компонентами. Обычно в интерметаллических соединениях связь между атомами – металлическая.
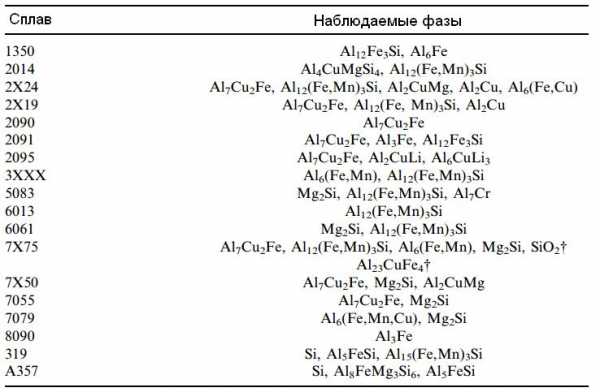
Интерметаллические соединения имеет большое значение для микроструктуры и свойств алюминиевых сплавов. Например, железо и кремний являются примесями, которые всегда присутствуют в алюминии. Поскольку растворимость железа в твердом алюминии очень мала, то фазы Al-Fe или Al-Fe-Si можно найти в микроструктуре даже сверхчистого алюминия. Этими фазами могут быть интерметаллические соединения FeAl3, Fe3SiAl12, Al2Si2Al9 или FeAl6.
В алюминиевых сплавах насчитывается несколько десятков фаз, которые являются интерметаллическими соединениями. В сложных сплавах типа 2014 (система Al-Cu-Mg-Mn-Fe-Si) эти соединения имеют вид типа (Mn,Fe)3SiAl12 [3].
Таблица – Интерметаллические соединения алюминия [2]
Источники:
1. http://www.inchem.org/documents/ehc/ehc/ehc194.htm
2. Handbook of Aluminum: Vol. 1: Physical Metallurgy and Processes / ed. G. E. Totten, D. S. MacKenzie – 2003.
3. Aluminium and Aluminium Alloys /ed. J.R. Davis – ASM International, 1993.
aluminium-guide.ru
Сфера применения алюминия и его сплавов в промышленности и быту.
Ключевое место алюминия в производственном процессе.
Алюминий – легкий, пластичный металл, один из наиболее распространённых химических элементов, содержащихся в земной коре. Алюминий очень удобен в использовании, поскольку имеет высокую устойчивость к коррозии, обладает электропроводимостью и устойчив к резким перепадам температур. Взаимодействуя с воздухом приобретает качественное преимущество – на поверхности металла образовывается твердая пленка, замедляющая естественное старение. Существуют несколько методов производства алюминия, но наладить этот процесс получилось лишь в ХХ веке.
Области применения алюминия.
Алюминий податлив штамповке, имеет значительную коррозийную стойкость, обладает высокой теплопроводностью, не токсичен в соединениях, поэтому он стал популярным конструкционным материалом. Области применения алюминия чрезвычайно обширны. В частности, он стал первым материалом для изготовления конструкций в авиастроении, ракетостроении, пищевой промышленности и производстве посуды. Благодаря своим качественным характеристикам алюминий способен ускорить судна и их маневренность. Более того, изделия и конструкции получаются легче, чем из стали на 50%.
Отдельно выделяют способности алюминия при проводимости тока. Таким образом, он, по праву может составить конкуренцию меди. Имея, практически такую же электропроводимость, он стал экономически выгодным заменителем. Активно применяется в микроэлектронике, при изготовлении компонентов микросхем. Единственным минусом, применения его в данной сфере, выступает образование диэлектрической пленки, способное создавать высокую температуру в местах спайки. Существует определенное условие использования алюминия, в качестве проводника.
Применение алюминия в промышленном производстве и в повседневном быту.
Перечислим основные сферы применения алюминия:
- Авиационное строительство: изготовление двигателей, корпусов, насосов, коробок передач, прочих деталей.
- Ракетостроение: в качестве горючего компонента ракетного топлива (гидриды алюминия, боранаты алюминия, триметилалюминии, триэтилалюминии, трипропилалюминии).
- Судостроительные производства: изготовление палубных надстроек и основных корпусов.
- Электроника: изготовление проводов, с высокой проводимостью тока и их напыления, кабелей, конденсаторов, выпрямителей, приборных корпусов.
- Оборонная промышленность: стрелковое оружие (автоматы, пистолеты), ракеты, танки, самолеты и боевые установки.
- Строительная промышленность: изготовление каркасов домов, лестниц, оконных рам, элементы отделки, используется в качестве газообразующего элемента.
- ЖД перевозки используют алюминиевые цистерны для транспортировки продуктов нефтяной промышленности. Производят: рамы для вагонов, детали для кузовов, рефрижераторные вагоны.
- Автомобильное конструирование: бампер, радиатор, отопительные детали.
- Применение в быту: посуда, фольга, корпус и детали бытовых приборов (спирали электронагревателя – фехрали).
- Криогенная техника: алюминий сохраняет свои свойства при низких температурах.
- Используют при производстве сероводорода (сульфид).
- Изготовление зеркал (благодаря высокому коэффициенту отражения) и стекловарение (фториды, фосфаты, оксиды алюминия).
К тому же, алюминиевые соединения используются для восстановления редких металлов, в качестве компонента смеси алюмотермии и протектора, также для пиротехники. Несмотря на множество преимуществ, есть один недостаток – невысокая прочность. Для того, чтобы сделать его более прочным, в производстве применяется крепкое соединение алюминия – дюралюминий (компонуя с медью и магнием). Ранее алюминий часто использовался для изготовления ювелирных изделий, в некоторых странах он заменяет серебряные украшения.
naruservice.com
Применение алюминия и его соединений

Наибольшее применение находит алюминий в виде металла. Он используется для получения легких сплавов, являющихся основным конструкционным материалом для космической и авиационной техники, речных судов и катеров.
Алюминий обладает высокой электропроводностью, благодаря чему идет на производство электрических проводов и кабелей. Из-за высокой теплопроводности алюминий и его сплавы применяют при производстве радиаторов для обогрева и отвода теплоты во многих устройствах и конструкциях.
Мелкодисперсный алюминиевый порошок (алюминиевая пудра) используются в качестве пигмента в красках. Природный минерал корунд, представляющий собой чистый кристаллический оксид алюминия, из-за высокой твердости применяется в качестве абразивного материала, а синтетический оксид алюминия – в производстве керамики, устойчивой при очень высоких температурах. Природные монокристаллы оксида алюминия (это минералы рубин, сапфир) являются драгоценными камнями и используются в производстве ювелирных украшений.
Очень важное значение имеет каолинит (основной компонент глины), огромные количества которого расходуются при производстве цемента. На первой стадии его получения шихту, состоящую из глины, известняка и ряда добавок, подвергают обжигу во вращающихся печах при 1500 ºC. При этом протекают сложные процессы образования алюмосиликатов кальция. В результате образуется цементный клинкер – спекшиеся очень твердые гранулы. Вторая стадия получения цемента – измельчение клинкера и получение порошкообразного цемента, способного необратимо твердеть при смешивании с водой. Огромные количества цемента используются в строительстве. Вам необходимо включить JavaScript, чтобы проголосовать
abouthist.net
Соединения алюминия. Применение алюминия
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Ход урока
I. Организационный момент:
а) приветствие;
б) объявление темы урока, запись в тетрадь;
в) основные учебные, воспитательные задачи урока.
Итак, ребята, ваш трудовой учебный день продолжается уроком химии, на котором вы познакомитесь с основными соединениями алюминия и их применением.
Основные задачи урока: усвоить основные соединения алюминия, познакомиться с их свойствами, закрепить понятие “амфотерность”, практические навыки при выполнении лабораторной работы, повторить правила по технике безопасности при работе с растворами кислот, щелочей, прививать экономное расходование реактивов.
Опрос пройденного материала в форме “деловой игры”.
а) группа “Поиск” (3 человека)
Задание: используя имеющуюся в классе
литературу, подготовить краткое сообщение о
применении алюминия.
б) группа “Экспериментатор” (2
человека)
Задание: из имеющихся реактивов получить
гидроксид алюминия. Составить схему превращений,
написать уравнения химических реакций с
пояснениями, т. е. в ОВР или ТЭД.
в) группа “Экономист-расчетчик” (2
человека)
К вам на предприятие поступил хлорид алюминия, из
которого получают алюминий. Химики-лаборанты
установили, что данная партия содержит 0,2
массовых долей примесей. Составить задачу и
рассчитать, сколько данного сырья необходимо
взять для получения 30 кг алюминия? Указать способ
получения алюминия”.
г) Ответ у доски-схемы;
д) ответ по схеме “опорный сигнал”;
е) задание всему классу, а один ученик выполняет у
доски-раскладушки, а затем сверяют:
алюминий–>соль
алюминия–>алюминий–>гидроксид
алюминия–>оксид алюминия.
Используя формулы указанных соединений, а также условия протекания предложенных реакций.
Ответы учащихся.
1. Приложение №1 химический диктант.
2. Ответ по схеме “Опорный сигнал”. На данной схеме найти уравнения реакций, объясняющие амфотерные свойства алюминия, написать их в ОВР и указать окислитель, восстановитель. Приложение №1
3. Ответ группы “Поиск”.
Каждый из учащихся, используя полученные физические и химические свойства, применение алюминия делает сообщение Приложение №3. Ответ группы “Экономист-расчетчик”.
Один из учащихся зачитывает задание, затем условие составленной задачи и объясняет ход решения, способ получения алюминия из данного сырья.
Задача должна иметь примерно такое содержание: “Сколько хлорида алюминия, содержащего 0,2 массовых долей примесей, необходимо взять для получения 30 кг алюминия?”.
Алюминий из хлорида алюминия можно получить электролизом расплава этого сырья, предварительно очистив его от примеси.
Дано: m (Al)=30кг (прим)=0,2 |
Решение. |
m(AlCl3)чист |
4. Ответ группы “Экспериментатор”. Читают задание, называют схему превращений:
5.Отвечает ученик из класса (а ученик у доски, открыв её) проверяет правильность выполнения.
III. Объяснение нового материала. Итак, ребята, мы на этом уроке неоднократно встречались с формулами веществ, которые относятся к основным соединениям алюминия. Кто их назовёт? Ребята называют вещества, их формулы, а я записываю их на разных досках.
Al2O3
— оксид алюминия, химическая, молекулярная, эмпирическая формула. Al2O3 образован ионным видом связи.Al2O3
— твёрдое вещество, по твёрдости уступает только алмазу, тугоплавкое (2050°) В природе встречается в виде минерала-корунда, окрашенные кристаллы – это драгоценные камни: красные-рубины; синие – сапфиры; фиолетовые – аметисты.– амфотерный оксид, в воде не растворим и с ней не взаимодействует, но взаимодействует с кислотой и щёлочью. – проявляет свойства основного оксидаurok.1sept.ru
Применение алюминия и его соединений
Получение
Химические свойства
Физические свойства
Гидроксид алюминия
Получение
Химические свойства
α-Al2O3 – амфотерный оксид, химически инертен, благодаря своей прочной кристаллической решетке. Он не растворяется в воде, не взаимодействует с растворами кислот и щелочей и может реагировать лишь с расплавленной щелочью.
Около 1000°С интенсивно взаимодействует со щелочами и карбонатами щелочных металлов с образованием алюминатов:
Al2O3 + 2KOH = 2KAlO2 + H2O;
Al2O3 + Na2CO3 = 2NaAlO2 + CO2.
Другие формы Al2O3 более активны, могут реагировать с растворами кислот и щелочей, α-Al2O3 взаимодействует лишь с горячими концентрированными растворами:
Al2O3 + 6HCl = 2AlCl3 + 3H2O;
Al2O3 + 2NaOH + 7H2O = 2Na[Al(H2O)2(OH)4]
Амфотерные свойства оксида алюминия проявляются при взаимодействии с кислотными и основными оксидами с образованием солей:
Al2O3 + 3SO3 = Al2(SO4)3 (основные свойства),
Al2O3 + Na2O = 2NaAlO2 (кислотные свойства).
Оксид алюминия – природное соединение, должна быть получен из бокситов или при термическом разложении гидроксидов алюминия:
2Al(OH)3 = Al2O3 + 3H2O;
2AlOOH = Al2O3 + H2O.
Гидроксид алюминия Al(OH)3 – бесцветное твердое вещество, нерастворимое в воде, входит в состав многих бокситов. Существует в четырех полиморфных модификациях. На холоде образуется α-Al(OH)3 – байерит, а при осаждении из горячего раствора γ-Al(OH)3 – гиббсит (гидаргилит), обе кристаллизуются в моноклинной сингонии, имеют слоистое строение, слои состоят из октаэдров [Al(OH)6], между слоями действует водородная связь. Существует также триклинный гиббсит γ’-Al(OH)3, триклинный нордстрандит β-Al(OH)3 и две модификации оксогидроксида AlOOH – орторомбические бемит и диаспор.
Размещено на реф.рф
Аморфный гидроксид алюминия имеет переменный состав Al2O3 · nH2O. При нагревании выше 180°С разлагается.
Гидроксид алюминия – типичное амфотерное соединение, свежеполученный гидроксид растворяется в кислотах и щелочах:
2Al(OH)3 + 6HCl = 2AlCl3 + 6H2O
Al(OH)3 + NaOH + 2H2O = Na[Al(H2O)2(OH)4].
При нагревании разлагается, процесс дегидратации довольно сложен и схематично должна быть представлен следующим образом:
Al(OH)3 = AlOOH + H2O;
2AlOOH = Al2O3 + H2O.
Образуется при действии водного раствора аммиака на растворы солей алюминия:
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl;
растворы щелочей не применяются, поскольку образующийся гидроксид алюминия в них хорошо растворяется.
Кристаллический гидроксид алюминия образуется при пропускании углекислого газа через щелочной раствор тетрагидроксодиакваалюмината натрия:
2Na[Al(H2O)2(OH)4] + 2СО2 = 2Al(OH)3 + 2NaHCO3 + 4H2O.
Алюминий используется для получения алюминиевых сплавов. Чистый алюминий – конструкционный материал в строительстве, применяется в электротехнике, является раскислителем чугуна и стали, восстановителем оксидов в производстве металлов методом алюмотермии. Применяется в качестве компонента твердых ракетных топлив, пиротехнических составов и взрывчатых веществ. В виде пудры и пасты применяется в качестве лакокрасочных материалов.
Оксид алюминия применяется в качестве огнеупорного и абразивного материала, для производства керамических резцов и электротехнической керамики. Монокристаллы используются в качестве лазерного материала, камней часовых механизмов и ювелирных камней. Алюмогель является адсорбентом при осушке газов и жидкостей, используется в хроматографии, применяется как носитель катализаторов.
Гидроксид алюминия используется при производстве соединений алюминия, компонент зубных паст, применяется в медицине.
Хлорид алюминия применяется в качестве катализатора в органическом синтезе, для очистки сточных вод и обработки дерева.
Сульфат алюминия – коагулянт для обработки питьевых и промышленных вод, применяется при производстве бумаги и в текстильной промышленности.
referatwork.ru
